Útipatika/Gyógyszerek stabilitása
Gyógyszerek stabilitása
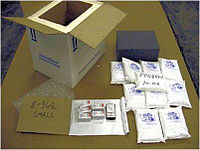
Csomagolás, és azok az összetevők, amelyek a gyógyszerek hideg hőmérsékleten történő szállítását biztosítják[1]. 2011. szeptember 13. 
Steril gyógyszerek, gyógyászati-segédeszközök szállításánál a sérülésmentességre is figyelni kell. 2011. február 20. 
Propecia tabletta 15-30 C° között, szobahőmérsékleten tárolandó. 2010. Június 29. - A gyógyszerek stabilitása egy ható-, segédanyag, illetve gyógyszerkészítmény a változások ellen irányuló azon képessége, hogy a felhasználhatósági idő végéig kizárólag a minőségi követelményekben rögzített határértékeken belül változva megőrizze fizikai, kémiai, mikrobiológiai és biofarmáciai tulajdonságait, vagyis minőségét, hatékonyságát és relatíve ártalmatlanságát[1]. A környezeti tényezők jelentősen befolyásolhatják a gyógyszerek stabilitását, amelyek a következők:
- Reaktív anyagok:
- oxigén, szén-dioxid, víz, egyéb (pl. OH-, H+ ), csomagolóanyag(tároló edényzet)
- Energia:[2]handbook on injectable drugs online :http://www.ashpintersections.org/2011/09/handbook-on-injectable-drugs-now-online/
- Gyógyszerek stabilitását, minőségét befolyásoló környezeti tényezők
- A fő környezeti tényezők a hőmérséklet, a páratartalom, és a fény. A gyógyszer tárolása, szállítása során gondoskodni kell ezek káros hatásának kiküszöböléséről egy utazás során is. A magas hőmérséklet és a fény a gyógyszerek spontán bomlását okozhatják, ezért a gyógyszeres dobozban található betegtájékoztató eltartásra, tárolásra vonatkozó utasításait is szigorúan be kell tartani, pl.: "Száraz, sötét, hűvös helyen tartandó!".
A gyógyszerek stabilitása és annak változásának következménye a gyógyszerben bekövetkező hatóanyag koncentrációjának csökkenése, és toxikus bomlástermékek megjelenése a gyógyszerben.
- Fizikai stabilitás:
- a gyógyszerkészítmény eredeti fizikai tulajdonságai (alak, íz, oldékonyság, kolloidikai tulajdonságok) nem változnak, vagy a rögzített határértéken belül változhat.
- Fizikai változás és következményei:
- halmazállapot (elfolyósodik), konzisztencia , viszkozitás (besűrűsödik), homogenitás (szétválik olaj- és víz-fázisra, törési szilárdság (porlékony lesz)
- Kémiai stabilitás:
- a gyógyszerkészítményben lévő összes hatóanyag kémiai tulajdonságai változatlan maradjon, vagy a rögzített határértéken belül változhat.
- Kémiai változás:
- elektronátmenettel járó oxidáció / redukció; lítikus reakciók hidrolízis; eliminációs reakciók dekarboxileződés / dezaminálás; addíciós reakciók polimerizáció; térbeli átrendeződések racemizáció / izomerizáció / stb.
- Kémiai változás következményei:
- csökken a hatóanyag-tartalom, toxikus bomlástermékek, szennyező anyagok felszaporodása
- Mikrobiológiai stabilitás:
- a gyógyszer steril maradjon vagy a mikroorganizmusok szaporodásával szembeni rezisztencia ne változzon. (Az alkalmazott tartósítószerek hatékonysága a tárolási idő alatt az előírásban rögzített határértéken belül változhat.)
- Mikrobiológiai változás:
- Terápiás stabilitás:
- a gyógyszerkészítmény terápiás(gyógyító) hatása ne változzon.
- Terápiás változás
- farmakológiai hatáscsökkenés, mellékhatások megjelenése
- Toxikológiai stabilitás:
- a gyógyszerkészítmény ártalmatlansága ne változzon.
- Toxikológiai változás:
- bomlástermék, mint szennyező ill. toxikus anyag megjelenése
- Gyógyszerformák hőérzékenysége tárolási hőmérséklet szerint

Gyógyszerek tárolása Dabakala városában. (Elefántcsontpart). , 2005. október 26.
Gyógyszerforma Tárolási/ szállítási hőmérséklet (°C) Hőérzékenység Szállítási feltételek[3] Oldat 2-8 Magas Nem fagyasztható; Felmelegedés utazás alatt akár 96 órán keresztül is, 15-25 °C-on elfogadható Liofilizált injekció 2-8 Közepes Meghosszabbított utazás alatt fagypont alatti hőmérséklet; Felmelegedés utazás alatt akár két hétig is, 15-25 °C-on elfogadható Tabletták 15- 25 Alacsony Forró utazás akár két hétig is, 40-50 °C-on elfogadható; Hideg utazás két hétig -20 °C-on elfogadható
Jegyzetek
- ↑ Gyógyszerstabilitás elvi alapjai I. dr. Dávid Ádám 2008. december 1. http://www.pharmtech.sote.hu/files/2008-2009/ea_stabilitas1_david-2008.pdf
- ↑ http://www.ashpintersections.org/2011/09/handbook-on-injectable-drugs-now-online/
- ↑ Mary Simpson, Edith Penxten and Elie Dechesne of Bristol-Meyers Squibb: Temperature Control Logistic; smaria.simpson@bms.com, edith.penxten@bms.com, elie.dechesne@bms.com.



